Desenvolvimento de modelos cinéticos detalhados para substitutos de combustíveis
Combustíveis reais e substitutos de gasolina
Como mencionado por Westbrook et al. (2005), a importância da modelagem computacional tem crescido nos campos da ciência e engenharia. Atualmente, é comum encontrar modelos numéricos que representam processos de combustão de hidrocarbonetos e, dependendo do foco das análises, são utilizados mecanismos cinéticos globais ou detalhados (Griffiths, 1995 e Simmie, 2003). Normalmente, os mecanismos detalhados permitem análises mais aprofundadas e têm sido utilizados no estudo de hidrocarbonetos puros, ou misturas com poucos componentes. Por exemplo, o conhecido modelo cinético para a oxidação do isooctano puro proposto por Curran et al. (2002) é composto por 857 espécies químicas envolvendo 3606 reações elementares. Um fator complicante neste cenário, porém, é que o número de espécies químicas presentes em uma gasolina real pode chegar a centenas, envolvendo hidrocarbonetos saturados e insaturados, incluindo alcanos, ciclo-alcanos, alquenos, ciclo-alcenos, aromáticos e outros componentes cuja indentidade e quantidades são usualmente desconhecidas (Metcalfe, 2007). Assim, um modelo cinético detalhado para um combustível real envovendo centenas de espécies químcias pode demandar um aumento dramático no número de reações elementares, tornando a abordagem numérica impossível com os recursos computacionais atuais.
O desenvolvimento de substitutos de gasolina é uma das alternativas para possibilitar o desenvolvimento de mecanismos cinéticos para combustíveis reais. Um substituto de gasolina consiste em uma mistura com um pequeno número de componentes os quais são usados para representar o combustível real conservando a previsão das principais características deste. Estas características desejáveis podem incluir, por exemplo, o comportamento da ignição, a velocidade de queima, a viscosidade, a curva de pressão de vapor e a emissão de poluentes (Metcalfe, 2007). É muito improvável reproduzir todas as características do combustível com uma única mistura simples. Portanto, a escolha da mistura depende do foco da análise e de critérios estabelecidos pelo analista.
Predição numérica / dados experimentais = validação de mecanismos cinéticos
A predição numérica do comportamento cinético / químico de um combustível real é um dos maiores desafios na grande área de pesquisa em combustão. O comportamento cinético de um combustível pode ser definido em termos de várias medições experimentais, sendo as mais comuns as seguintes:
- Atraso de ignição em tubos de choque ou máquina de compressão rápida
- Formação / destruição de espécies químicas em reatores químicos (PSR, PFR, etc.)
- Velocidade de chama laminar (em queimador de chama plana, reator de volume constante, etc.)
Um modelo cinético, além de representar o combustível real com um grupo reduzido de espécies químicas (substitutos de combustível), precisa reproduzir numericamente as medições de experimentos fundamentais em processos de combustão de forma satisfatória.
A ideia principal para o desenvolvimento de modelos cinéticos detalhados para substitutos de combustíveis é abordar a cinética química de cada espécie (substituto de combustível) e posteriormente ir juntado estas diferentes estruturas cinéticas.
Mecanismos cinéticos para misturas ternarias de substitutos de gasolina
A tabela 1 mostra a formulação de três substitutos de gasolina, tomando como referência 4 espécies químicas principais: Etanol, i-octano, n-heptano e tolueno. Observe-se que neste caso, a formulação do combustível foi feita tentando atingir certo valor do índice de octanos da mistura de substitutos.

Table 1. Fuels surrogates: Ethanol, i-octane, n-heptane and toluene (L.R. Cancino et al. / Proceedings of the Combustion Institute 32 (2009) 501–508).
A tabela 2 mostra as referencias dos diferentes modelos cinéticos detalhados que conformaram os modelos cinéticos das misturas de substitutos de combustíveis (Gasoline surrogate A, B and C)

Table 2. Base-line detailed kinetics model for ethanol, i-octane, n-heptane and toluene (L.R. Cancino et al. / Proceedings of the Combustion Institute 32 (2009) 501–508).
A figura 1 mostra os resultados experimentais em tubos de choque comparados com os resultados numéricos usando os mecanismos cinéticos desenvolvidos para os substitutos de combustíveis.

Figure 1. Simulation and experimental results for all surrogates/air ignition delay times at p5 = 30 bar. Φ = 1.0 (see Tables 1 and 2 for composition and submechanisms models – L.R. Cancino et al. / Proceedings of the Combustion Institute 32 (2009) 501–508)
Esta figura, no eixo y é dado o valor do atraso de ignição numa escala logarítmica e em microsegundos, no eixo x é dado o valor da temperatura em escala adimensional (1000 K / T) indicando que perto da origem estão os valores mais altos de temperatura e longe da origem os valores mais baixos. Usualmente são cobertos valores de temperatura entre 1250 K < T < 650 K.
Na figura 1 pode ser observado que os três modelos cinéticos propostos superestimam o valor do atraso de ignição medido em tubo de choque, no entanto, os três modelos conseguem representar a tendência do atraso de ignição. Observe-se também que, usando o modelo cinético podem ser feitas predições numéricas de valor de atraso de ignição na região de baixas temperaturas (1000/T > 1.1, T < 900 K) no caso do substituto de gasolina C (linha tracejada e triangulos verdes ( na figura 1), região na qual não foi possível realizar experimentos.
É necessário destacar que, um modelo cinético desenvolvido para uma mistura de hidrocarbonetos substitutos de combustível, precisa reproduzir a cinética química de cada uma das espécies químicas para as quais foi desenvolvido o mecanismo, de forma separada e usando misturas binárias, terciárias, quaternárias etc., das espécies substitutos de combustíveis.
Mecanismo cinético para mistura multicomponente de substitutos de gasolina
Em um trabalho mais recente, foi desenvolvido um mecanismo cinético detalhado para misturas multicomponentes de substitutos de combustíveis contendo etanol. Este mecanismo cinético detalhado foi validado para dados experimentais de atraso de ignição em tubos de choque de espécies puras, misturas binárias, ternárias, quaternárias e uma mistura quinaria. A mistura quinaria foi composta por iso-octano / tolueno / n-heptano / di-iso-butileno / etanol, na proporção volumétrica de 30% / 25% / 22% / 13% / 10% respectivamente. A figura 2 mostra as estruturas moleculares das espécies químicas escolhidas como sendo substitutos de combustíveis.

Figura 2. Estrutura molecular dos componentes dos substitutos de gasolina considerados no desenvolvimento do mecanismo cinético detalhado
A figura 3 mostra a comparação de valores de atraso de ignição entre dados experimentais em tubos de choque e predição numérica obtida com o mecanismo cinético detalhado. O lado da direita mostra os dados para espécies químicas puras (etanol, i-octano e tolueno) em ar, em condições estequiométricas e pressões de 10 bar até 50 bar. Do lado esquerdo da figura 3, são comparados os dados experimentais de misturas binárias (n-heptano/i-octano, etanol/i-octano e PRF0-PRF100) em ar, em condição estequiométrica e pressões entre 30 e 40 bar.

Figura 3. Comparação de resultados numéricos e experimentais para espécies químicas puras (esquerda) e misturas binárias (direita), usando o mecanismo cinético detalhado para misturas multicomponentes. (L.R. Cancino et al. / Fuel 90 (2011) 1238–1244)
A figura 4 mostra a comparação de valores de atraso de ignição entre dados experimentais em tubos de choque e predição numérica obtida com o mecanismo cinético detalhado para mistura multicomponente. O lado da direita mostra os dados para misturas ternárias (i-octano / tolueno / n-heptane) em ar, em condições estequiométricas e pressões de 10 bar até 50 bar. Do lado esquerdo da figura 4, são comparados os dados experimentais de misturas quaternárias (tolueno / i-octano / n-heptano / di-iso-butileno, etanol / i-octano / n-heptano / tolueno) em ar, em condição estequiométrica e pressões entre 10 e 50 bar.
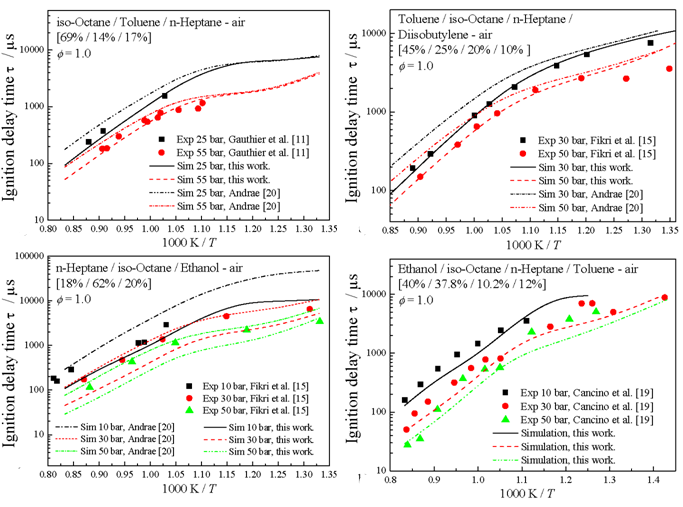
Figura 4. Comparação de resultados numéricos e experimentais para misturas ternárias (esquerda) e misturas quaternárias (direita), usando o mecanismo cinético detalhado para misturas multicomponentes. (L.R. Cancino et al. / Fuel 90 (2011) 1238–1244)
A figura 5 mostra resultados numéricos e experimentais de atraso de ignição térmica em tubo de choque, assim como uma analise de sensibilidade feita no mecanismo cinético detalhado para misturas multicomponentes. Do lado direito mostra a validação do mecanismo para uma mistura quinaria (i-octano / tolueno / n-heptane / di-iso-butileno / etanol) em ar, em condições estequiométricas e pressões de 10 bar e 30 bar

Figura 5. Comparação de resultados numéricos e experimentais para a mistura quinária (esquerda) e analise de sensibilidade (direita), usando o mecanismo cinético detalhado para misturas multicomponentes. (L.R. Cancino et al. / Fuel 90 (2011) 1238–1244)




